انتقل إلى وضع عدم الاتصال باستخدام تطبيق Player FM !
WSR037-Pflaster, Beatmungsgeräte, Implantate: Medizinprodukte - Interview mit Dr. Ulrich Froriep
Manage episode 280510728 series 2455498
Bernd und André sind zu Gast am Fraunhofer-Institut für Toxikologie und experimentelle Medizin (ITEM) und sprechen mit Dr. Ulrich Froriep vom Leistungszentrum Translationale Medizintechnik.

In dieser Episode geht es um Medizinprodukte und deren Zertifizierung. Seit dem Jahr 2017 gibt es eine neue EU-Verordnung, die diese Zertifizierung regelt und ab Mai 2021 so einiges schwieriger macht. Aber es gibt auch Hoffnung was diese Schwierigkeiten angeht durch das EU-Projekt MDOT beispielsweise. Außerdem geht es um Cochlea-Implantate, regulatorische Forschung, Medizinprodukte aus dem 3D-Drucker, die Apple Watch und einiges mehr.
(Im Podcast gibt es Kapitelmarken, die den Zwischenüberschriften hier im Text entsprechen, so dass es einfacher ist, bestimmte Teile erneut zu hören. Nicht jede Kapitelmarke hat eine Zwischenüberschrift, manchmal fassen wir mehrere Kapitel zusammen.)
Was ist ein Medizinprodukt?
Medizinprodukte sind beispielsweise Beatmungsgerät, Insulinpumpen, Pflaster, Krankenhausbetten oder auch einige „Health-Apps“. Sobald etwas zu Therapie- oder Diagnosezwecken verwendet werden kann und die Wirkung nicht pharmakologischer Natur ist, handelt es sich um ein Medizinprodukt. Also eine deutliche Abgrenzung zu Arzneimitteln.
Diese Abgrenzung rührt daher, dass der gesamte Zulassungsprozess für Dinge, die nicht pharmakologisch wirken sondern physikalisch, wie beispielsweise ein Herzschrittmacher, ein deutlich anderer ist als der Zulassungsprozess für einen Arzneistoff. Und hier gibt es auch noch Feinheiten, wie Herr Froriep ausführt: Arzneimittel werden in Deutschland von einer Behörde zugelassen, Medizinprodukte werden zertifiziert – europaweit, und das Zeichen dafür ist das CE-Kennzeichnung.
Was muss zur Zertifizierung getestet werden?
Es wird immer vom Standpunkt der Risikobeurteilung ausgegangen: Wie groß ist das Risiko einer Schädigung? Welche Risiken kann man kontrollieren oder sogar abstellen und welche nicht? All das, und noch viel mehr ist in Deutschland durch das Medizinproduktgesetz geregelt, in verschiedenen Risikoklassen.
Forschung im Bereich Medizinprodukte
Dr. Ulrich Froriep beschäftigt sich am ITEM mit mehreren Bereichen. Einmal kümmert es sich um den Bereich der Entwicklung von Ergebnissen aus der Grundlagenforschung hin zu Medizinprodukten – er und sein Team begleiten den Prozess. Er kümmert sich aber auch um die Entwicklung von neuen Testmethoden, um Voraussetzungen zur Zertifizierung von Medizinprodukten die auf einer neuen Erkenntnis beruhen sicher zu stellen. Diese neuen Erkenntnisse können schlicht ein neuer Werkstoff sein, bis hin zu ganz neuen Mechanismen. Außerdem bietet er in seiner Abteilung das Fachwissen wie der Zertifizierungsprozess für Medizinprodukte abläuft, sowohl für Industriepartner als auch für Wissenschaftler*innen.
Neue EU-Verordnung und Skandale
Es gab einige Skandale zu verschiedenen Implantaten. Hüftimplantate waren ein Thema, aber auch Brustimplantate. Aus diesen und einigen anderen Skandalen ging dann die EU Medical Device Regulation (EU MDR) hervor, die seit 2017 Gesetz ist und den Charakter einer Verordnung besitzt. Seit Mai 2020 sollte diese Verordnung eigentlich volle Gültigkeit haben, und jeder in der EU sollte danach arbeiten müssen – wegen Covid-19 wurde dies aber auf den Mai 2021 verschoben.
Vorher gab es eine EU Richtlinie zu Medizinprodukten, das waren Vorgaben, an denen sich nationales Recht zu orientieren hatten. Eine EU-Verordnung ist wie ein Gesetz, das heißt es hier muss nicht noch ein eigenes Gesetz der einzelnen Nationalstaaten verfasst werden, sondern die EU MDR gilt überall in Europa wie ein Gesetz.
Herr Froriep ordnet ein, was diese Verordnung bewirken wird: Es werden strenge Vorgaben für die Tests zur Zertifizierung gemacht. Es gibt neue Risikoklassen und viele Regelungen sind nun schärfer gestaltet. Allerdings werden dadurch nicht zwangsläufig die oben angesprochenen Skandale verhindert, denn was dort missachtet worden ist, war auch schon nach der alten Gesetzgebung illegal.
Viele bereits zertifizierte Medizinprodukte müssen nach der neuen EU-Verordnung neu bewertet werden, nicht zuletzt wegen der neuen Risikoklassen – was einige Probleme mit sich bringt, die nicht direkt offensichtlich sind. Einige Medizinprodukte werden wohl aus Europa verschwinden, da die erneute Zertifizierung für einige Hersteller zu kostspielig sein wird. Gerade Medizinprodukte mit einer geringen Anwenderzahl sind hier betroffen – also nicht zwangsläufig unsichere Medizinprodukte, sondern solche mit geringen Stückzahlen.
Was ist ein Qualitätsmanagement?
Im Fall der Medizinprodukte gibt es eine eigene ISO, nämlich die ISO 13485, mit dem Titel „Medizinprodukte – Qualitätsmanagementsysteme – Anforderungen für regulatorische Zwecke“.
Projekte am ITEM
Dr. Froriep arbeitet an einigen Projekten in seinem Labor am Fraunhofer ITEM. Über sein Projekt zur Beatmung von Frühgeborenen gab es auch vor einiger Zeit einen Artikel in „Fraunhofer. Das Magazin“: Ihr Kinderlein – wartet?.
Cochlea-Implantate
Herr Froriep spricht – als gutes Beispiel – Cochlea-Implantate an. Dabei handelt es sich um eine besondere Form des Hörgeräts, bei dem Elektroden direkt in die Gehörschnecke implantiert werden. Die Technologie in diesen Implantaten ist relativ alt – man kann damit Hörvermögen verbessern, allerdings eignen sich diese Geräte nicht für das Hören von Musik oder dem Verfolgen von Gesprächen zwischen vielen Menschen, die teilweise gleichzeitig reden. Denn solche Implantate werden nicht neu entwickelt, da die Zertifizierung eines neuen Implantates, Kategorie Hochrisiko-Implantat, da es direkt am Hörnerv liegt, sehr langwierig und kostspielig ist. Ein anderes Beispiel sind Roboterarme die mit Hilfe von Gedanken gesteuert werden. Alle Beispiele die man dazu findet ,kommen aus der Forschung, denn der letzte Schritt hin zu einem fertigen Medizinprodukt wurde bisher noch nicht gemacht – solche komplexen Roboterarme gibt es bisher nicht als Medizinprodukt zertifiziert.
Aufgabe des Leistungszentrums Translationale Medizintechnik
Im Leistungszentrum Translationale Medizintechnik beschäftigt man sich mit vielerlei Dingen: Mit neuen Tests für die Zertifizierung von Medizinprodukten, aber auch mit dem Vorgehen zur Zertifizierung an sich.
Besonders der Bereich der neuen Materialien ist spannend. Noch vor ca. 20 Jahren war der Fokus vor allem auf sehr harten Materialien, wie Keramik. Mittlerweile werden vor allem weiche Materialien wie Hydrogele oder Polymere erforscht und entwickelt, um sie in Medizinprodukten einzusetzen. Dabei ist die Herausforderung, überhaupt zu testen wie langlebig diese weichen Materialien sind, denn die bisherigen Tests für die harten Materialien lassen sich nicht einfach übernehmen – und daran wird am ITEM gearbeitet.
EU-Projekt MDOT
Mit dem EU-Projekt MDOT sollen Medizintechnikunternehmen entlastet werden.
-
- Pressemitteilung zu MDOT, Fraunhofer ITEM
Regulatorische Forschung
Am Fraunhofer ITEM wird auch daran gearbeitet, bessere Informationsflüsse zu gestalten. Herr Froriep führte beispielsweise an, dass ein Hersteller der Material X in Schulterimplantaten verwendet, keine Informationen erhält, wenn das gleiche Material X bei einem Hersteller von Knieimplantaten Probleme verursacht hat.
Regulatorische Forschung bedeutet einerseits, dass nach Datenströmen innerhalb der Regelungen gesucht wird, um Informationsflüsse zu gestalten, die allen Beteiligten bessere und frühere Informationen zur Verfügung stellen und andererseits die Weiterentwicklung der Testung.
3D-Druck, Apple-Watch und Apps
Bernd und André sprechen mit Herrn Froriep auch noch über moderne Technologien wie Medizinprodukte aus dem 3D-Drucker, die Apple-Watch oder Health-Apps. Zusammenfassend kann man sagen: Die individuelle Medizin ist gar nicht so neu wie man meint, Zahnärzte betreiben sie bereits seit Jahrzehnten. Aber mehr Daten und dadurch bessere Behandlungsmethoden halten auch Schwierigkeiten für die Zertifizierung von Medizinprodukten bereit.
Außerdem geht es zum Abschluss auch um den Werdegang von Dr. Ulrich Froriep und wie er dazu gekommen ist, das zu tun was er tut.
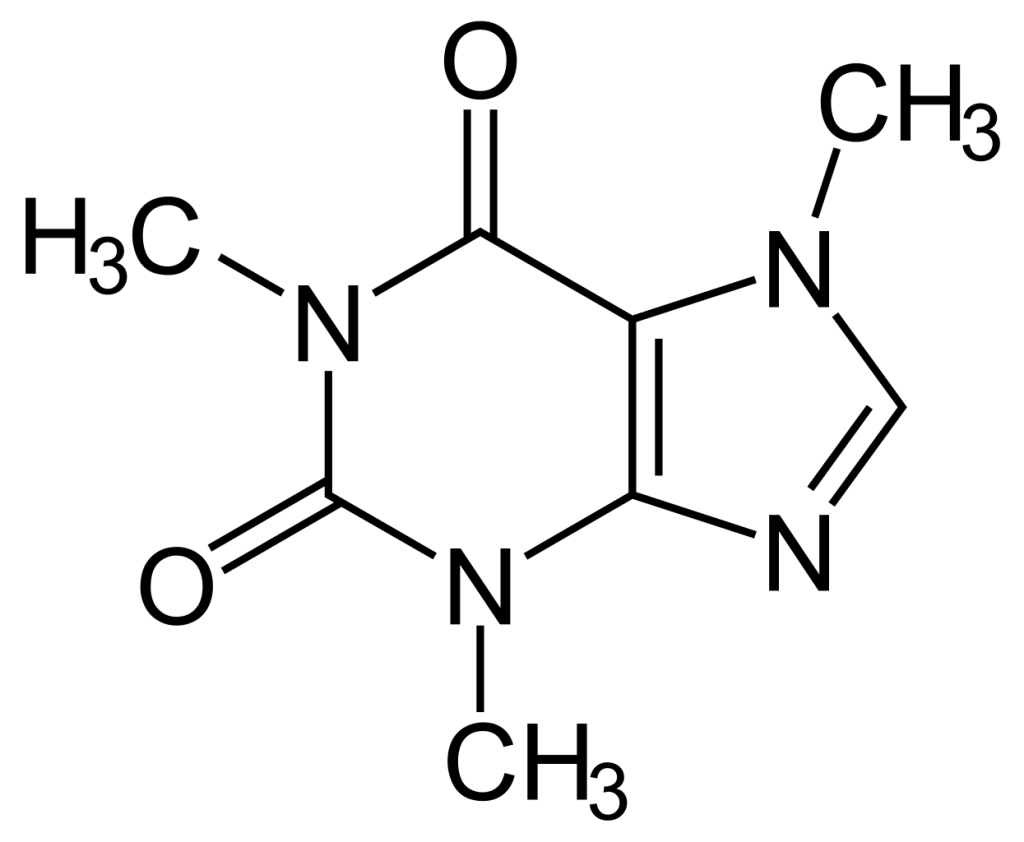
Lieblingsmolekül
Das Lieblingsmolekül von Herrn Froriep ist das Coffein.
Wir bedanken uns ganz herzlich bei Dr. Ulrich Froriep für seine Zeit und die Erklärungen und Einordnungen und beim Fraunhofer-Insitut für Toxikologie und experimentelle Medizin (ITEM) für die Unterstützung bei der Aufnahme dieser Episode.
Wir freuen uns immer über Feedback: per Mail unter info@wirkstoffradio.de, in den Kommentaren unter den einzelnen Episoden, über Twitter @wirkstoffradio oder auch als Bewertung bei iTunes oder panoptikum.social.
Wirkstoffradio-Feedback-Telefon +49 (0)30 746 910 64
- André Lampe
- Bernd Rupp
- Dr. Ulrich Froriep
Wirkstoffradio ist lizenziert unter einer Creative Commons Namensnennung - Keine Bearbeitungen 4.0 International Lizenz.
فصول
1. Begrüßung (00:00:00)
2. Was ist ein Medizinprodukt? (00:01:34)
3. Warum die Abgrenzung zu Arzneimitteln? (00:04:11)
4. Was muss zur Zertifizierung getestet werden? (00:07:39)
5. Forschung im Bereich Medizinprodukte (00:14:52)
6. Software und KI in Medizinprodukten (00:22:13)
7. Neue EU-Verordnung und Skandale (00:24:12)
8. Was ist ein Qualitätsmanagement? (00:34:46)
9. Projekte am ITEM (00:40:46)
10. Cochlea-Implantat (00:46:02)
11. Aufgabe des Leistungszentrums Translationale Medizintechnik (00:52:46)
12. EU-Projekt MDOT (00:59:15)
13. Regulatorische Forschung (01:06:13)
14. Wie zertifiziert man Medizinprodukte aus dem 3D-Drucker? (01:11:55)
15. Apple Watch (01:20:48)
16. Nachfrage zu Apps (01:25:47)
17. Werdegang (01:27:33)
18. Lieblingsmolekül (01:33:18)
19. Verabschiedung und Bitte um Feedback (01:35:06)
85 حلقات
Manage episode 280510728 series 2455498
Bernd und André sind zu Gast am Fraunhofer-Institut für Toxikologie und experimentelle Medizin (ITEM) und sprechen mit Dr. Ulrich Froriep vom Leistungszentrum Translationale Medizintechnik.

In dieser Episode geht es um Medizinprodukte und deren Zertifizierung. Seit dem Jahr 2017 gibt es eine neue EU-Verordnung, die diese Zertifizierung regelt und ab Mai 2021 so einiges schwieriger macht. Aber es gibt auch Hoffnung was diese Schwierigkeiten angeht durch das EU-Projekt MDOT beispielsweise. Außerdem geht es um Cochlea-Implantate, regulatorische Forschung, Medizinprodukte aus dem 3D-Drucker, die Apple Watch und einiges mehr.
(Im Podcast gibt es Kapitelmarken, die den Zwischenüberschriften hier im Text entsprechen, so dass es einfacher ist, bestimmte Teile erneut zu hören. Nicht jede Kapitelmarke hat eine Zwischenüberschrift, manchmal fassen wir mehrere Kapitel zusammen.)
Was ist ein Medizinprodukt?
Medizinprodukte sind beispielsweise Beatmungsgerät, Insulinpumpen, Pflaster, Krankenhausbetten oder auch einige „Health-Apps“. Sobald etwas zu Therapie- oder Diagnosezwecken verwendet werden kann und die Wirkung nicht pharmakologischer Natur ist, handelt es sich um ein Medizinprodukt. Also eine deutliche Abgrenzung zu Arzneimitteln.
Diese Abgrenzung rührt daher, dass der gesamte Zulassungsprozess für Dinge, die nicht pharmakologisch wirken sondern physikalisch, wie beispielsweise ein Herzschrittmacher, ein deutlich anderer ist als der Zulassungsprozess für einen Arzneistoff. Und hier gibt es auch noch Feinheiten, wie Herr Froriep ausführt: Arzneimittel werden in Deutschland von einer Behörde zugelassen, Medizinprodukte werden zertifiziert – europaweit, und das Zeichen dafür ist das CE-Kennzeichnung.
Was muss zur Zertifizierung getestet werden?
Es wird immer vom Standpunkt der Risikobeurteilung ausgegangen: Wie groß ist das Risiko einer Schädigung? Welche Risiken kann man kontrollieren oder sogar abstellen und welche nicht? All das, und noch viel mehr ist in Deutschland durch das Medizinproduktgesetz geregelt, in verschiedenen Risikoklassen.
Forschung im Bereich Medizinprodukte
Dr. Ulrich Froriep beschäftigt sich am ITEM mit mehreren Bereichen. Einmal kümmert es sich um den Bereich der Entwicklung von Ergebnissen aus der Grundlagenforschung hin zu Medizinprodukten – er und sein Team begleiten den Prozess. Er kümmert sich aber auch um die Entwicklung von neuen Testmethoden, um Voraussetzungen zur Zertifizierung von Medizinprodukten die auf einer neuen Erkenntnis beruhen sicher zu stellen. Diese neuen Erkenntnisse können schlicht ein neuer Werkstoff sein, bis hin zu ganz neuen Mechanismen. Außerdem bietet er in seiner Abteilung das Fachwissen wie der Zertifizierungsprozess für Medizinprodukte abläuft, sowohl für Industriepartner als auch für Wissenschaftler*innen.
Neue EU-Verordnung und Skandale
Es gab einige Skandale zu verschiedenen Implantaten. Hüftimplantate waren ein Thema, aber auch Brustimplantate. Aus diesen und einigen anderen Skandalen ging dann die EU Medical Device Regulation (EU MDR) hervor, die seit 2017 Gesetz ist und den Charakter einer Verordnung besitzt. Seit Mai 2020 sollte diese Verordnung eigentlich volle Gültigkeit haben, und jeder in der EU sollte danach arbeiten müssen – wegen Covid-19 wurde dies aber auf den Mai 2021 verschoben.
Vorher gab es eine EU Richtlinie zu Medizinprodukten, das waren Vorgaben, an denen sich nationales Recht zu orientieren hatten. Eine EU-Verordnung ist wie ein Gesetz, das heißt es hier muss nicht noch ein eigenes Gesetz der einzelnen Nationalstaaten verfasst werden, sondern die EU MDR gilt überall in Europa wie ein Gesetz.
Herr Froriep ordnet ein, was diese Verordnung bewirken wird: Es werden strenge Vorgaben für die Tests zur Zertifizierung gemacht. Es gibt neue Risikoklassen und viele Regelungen sind nun schärfer gestaltet. Allerdings werden dadurch nicht zwangsläufig die oben angesprochenen Skandale verhindert, denn was dort missachtet worden ist, war auch schon nach der alten Gesetzgebung illegal.
Viele bereits zertifizierte Medizinprodukte müssen nach der neuen EU-Verordnung neu bewertet werden, nicht zuletzt wegen der neuen Risikoklassen – was einige Probleme mit sich bringt, die nicht direkt offensichtlich sind. Einige Medizinprodukte werden wohl aus Europa verschwinden, da die erneute Zertifizierung für einige Hersteller zu kostspielig sein wird. Gerade Medizinprodukte mit einer geringen Anwenderzahl sind hier betroffen – also nicht zwangsläufig unsichere Medizinprodukte, sondern solche mit geringen Stückzahlen.
Was ist ein Qualitätsmanagement?
Im Fall der Medizinprodukte gibt es eine eigene ISO, nämlich die ISO 13485, mit dem Titel „Medizinprodukte – Qualitätsmanagementsysteme – Anforderungen für regulatorische Zwecke“.
Projekte am ITEM
Dr. Froriep arbeitet an einigen Projekten in seinem Labor am Fraunhofer ITEM. Über sein Projekt zur Beatmung von Frühgeborenen gab es auch vor einiger Zeit einen Artikel in „Fraunhofer. Das Magazin“: Ihr Kinderlein – wartet?.
Cochlea-Implantate
Herr Froriep spricht – als gutes Beispiel – Cochlea-Implantate an. Dabei handelt es sich um eine besondere Form des Hörgeräts, bei dem Elektroden direkt in die Gehörschnecke implantiert werden. Die Technologie in diesen Implantaten ist relativ alt – man kann damit Hörvermögen verbessern, allerdings eignen sich diese Geräte nicht für das Hören von Musik oder dem Verfolgen von Gesprächen zwischen vielen Menschen, die teilweise gleichzeitig reden. Denn solche Implantate werden nicht neu entwickelt, da die Zertifizierung eines neuen Implantates, Kategorie Hochrisiko-Implantat, da es direkt am Hörnerv liegt, sehr langwierig und kostspielig ist. Ein anderes Beispiel sind Roboterarme die mit Hilfe von Gedanken gesteuert werden. Alle Beispiele die man dazu findet ,kommen aus der Forschung, denn der letzte Schritt hin zu einem fertigen Medizinprodukt wurde bisher noch nicht gemacht – solche komplexen Roboterarme gibt es bisher nicht als Medizinprodukt zertifiziert.
Aufgabe des Leistungszentrums Translationale Medizintechnik
Im Leistungszentrum Translationale Medizintechnik beschäftigt man sich mit vielerlei Dingen: Mit neuen Tests für die Zertifizierung von Medizinprodukten, aber auch mit dem Vorgehen zur Zertifizierung an sich.
Besonders der Bereich der neuen Materialien ist spannend. Noch vor ca. 20 Jahren war der Fokus vor allem auf sehr harten Materialien, wie Keramik. Mittlerweile werden vor allem weiche Materialien wie Hydrogele oder Polymere erforscht und entwickelt, um sie in Medizinprodukten einzusetzen. Dabei ist die Herausforderung, überhaupt zu testen wie langlebig diese weichen Materialien sind, denn die bisherigen Tests für die harten Materialien lassen sich nicht einfach übernehmen – und daran wird am ITEM gearbeitet.
EU-Projekt MDOT
Mit dem EU-Projekt MDOT sollen Medizintechnikunternehmen entlastet werden.
-
- Pressemitteilung zu MDOT, Fraunhofer ITEM
Regulatorische Forschung
Am Fraunhofer ITEM wird auch daran gearbeitet, bessere Informationsflüsse zu gestalten. Herr Froriep führte beispielsweise an, dass ein Hersteller der Material X in Schulterimplantaten verwendet, keine Informationen erhält, wenn das gleiche Material X bei einem Hersteller von Knieimplantaten Probleme verursacht hat.
Regulatorische Forschung bedeutet einerseits, dass nach Datenströmen innerhalb der Regelungen gesucht wird, um Informationsflüsse zu gestalten, die allen Beteiligten bessere und frühere Informationen zur Verfügung stellen und andererseits die Weiterentwicklung der Testung.
3D-Druck, Apple-Watch und Apps
Bernd und André sprechen mit Herrn Froriep auch noch über moderne Technologien wie Medizinprodukte aus dem 3D-Drucker, die Apple-Watch oder Health-Apps. Zusammenfassend kann man sagen: Die individuelle Medizin ist gar nicht so neu wie man meint, Zahnärzte betreiben sie bereits seit Jahrzehnten. Aber mehr Daten und dadurch bessere Behandlungsmethoden halten auch Schwierigkeiten für die Zertifizierung von Medizinprodukten bereit.
Außerdem geht es zum Abschluss auch um den Werdegang von Dr. Ulrich Froriep und wie er dazu gekommen ist, das zu tun was er tut.
Lieblingsmolekül
Das Lieblingsmolekül von Herrn Froriep ist das Coffein.

Wir bedanken uns ganz herzlich bei Dr. Ulrich Froriep für seine Zeit und die Erklärungen und Einordnungen und beim Fraunhofer-Insitut für Toxikologie und experimentelle Medizin (ITEM) für die Unterstützung bei der Aufnahme dieser Episode.
Wir freuen uns immer über Feedback: per Mail unter info@wirkstoffradio.de, in den Kommentaren unter den einzelnen Episoden, über Twitter @wirkstoffradio oder auch als Bewertung bei iTunes oder panoptikum.social.
Wirkstoffradio-Feedback-Telefon +49 (0)30 746 910 64
- André Lampe
- Bernd Rupp
- Dr. Ulrich Froriep

Wirkstoffradio ist lizenziert unter einer Creative Commons Namensnennung - Keine Bearbeitungen 4.0 International Lizenz.
فصول
1. Begrüßung (00:00:00)
2. Was ist ein Medizinprodukt? (00:01:34)
3. Warum die Abgrenzung zu Arzneimitteln? (00:04:11)
4. Was muss zur Zertifizierung getestet werden? (00:07:39)
5. Forschung im Bereich Medizinprodukte (00:14:52)
6. Software und KI in Medizinprodukten (00:22:13)
7. Neue EU-Verordnung und Skandale (00:24:12)
8. Was ist ein Qualitätsmanagement? (00:34:46)
9. Projekte am ITEM (00:40:46)
10. Cochlea-Implantat (00:46:02)
11. Aufgabe des Leistungszentrums Translationale Medizintechnik (00:52:46)
12. EU-Projekt MDOT (00:59:15)
13. Regulatorische Forschung (01:06:13)
14. Wie zertifiziert man Medizinprodukte aus dem 3D-Drucker? (01:11:55)
15. Apple Watch (01:20:48)
16. Nachfrage zu Apps (01:25:47)
17. Werdegang (01:27:33)
18. Lieblingsmolekül (01:33:18)
19. Verabschiedung und Bitte um Feedback (01:35:06)
85 حلقات
All episodes
×مرحبًا بك في مشغل أف ام!
يقوم برنامج مشغل أف أم بمسح الويب للحصول على بودكاست عالية الجودة لتستمتع بها الآن. إنه أفضل تطبيق بودكاست ويعمل على أجهزة اندرويد والأيفون والويب. قم بالتسجيل لمزامنة الاشتراكات عبر الأجهزة.




